De nouvelles donnes sur la vaccination contre l’influenza aviaire
La vaccination contre les virus influenza aviaire a une connotation négative. L’arrivée de vaccins de nouvelle génération, la propagation mondiale et l’évolution des souches, les enjeux sanitaire et économique croissants vont-ils changer la donne ?
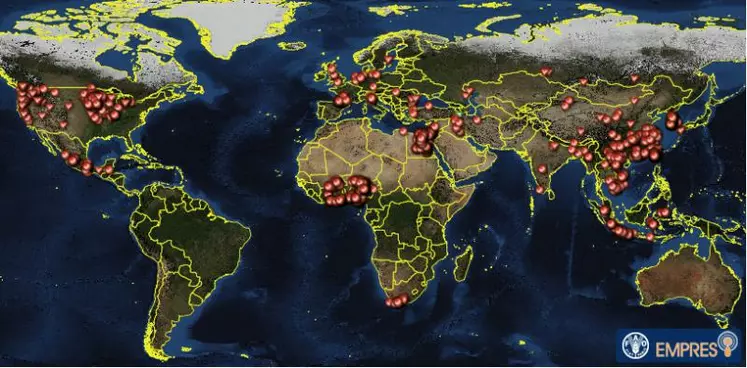





Pourquoi ne vaccine-t-on pas les volailles contre l’influenza aviaire (IA) ? L’actualité sanitaire qui touche la filière canard gras dans le Sud-Ouest amène à s’y interroger. Problématique de santé mondiale, l’IA a également suscité beaucoup d’échanges lors du symposium international organisé par le laboratoire Ceva.
L’influenza aviaire est une maladie infectieuse liée à un Orthomyxovirus dont il existe plusieurs souches classées en deux catégories : faiblement pathogène (FP) et hautement pathogène (HP). Chacune est caractérisée par deux protéines, situées en surface du virus : la protéine H (16 sous-types d’hémagglutinine ont été décrits à ce jour) et N (9 sous-types de neuraminidase), d’où leur dénomination par les termes H5N1, H5N9… Un virus FP est capable de muter puis de devenir HP. À ce jour, ce phénomène a été observé avec les seuls sous-types H5 et H7. Des réassortiments sont aussi possibles (mélanges de brins d'ARN issus de virus différents). Ces raisons rendent complexes toute stratégie de vaccination. « Il n’existe pas de vaccin universel contre l’IA », a expliqué David Swayne, directeur de recherche volaille de l’USDA aux USA. « Il doit être spécifique à chaque sous type H (on ne protège pas contre un virus H6 avec un vaccin H5 par exemple). » Par ailleurs, les méthodes de détection ne permettaient pas jusqu’à présent de toujours bien distinguer les animaux infectés des animaux vaccinés.
La vaccination est interdite dans de nombreux pays. C’est le cas en France, où elle est réservée à des programmes de protection très précis (parcs zoologiques par exemple) ou en cas d’urgence dans des conditions bien définies. Hors Europe, les positions divergent selon le contexte épidémiologique, l’organisation de la surveillance vétérinaire et la structure des filières de production. Là où le virus HP est endémique, la vaccination peut être appliquée de façon systématique (Chine, Égypte, Vietnam, Indonésie…) ou non (Nigéria, Inde). « D’autres pays utilisent la vaccination contre une souche FP comme moyen de contrôle.»
La vaccination, une mesure complémentaire
« Dans le cas d’un virus FP, les mesures de lutte à privilégier sont le renforcement de la biosécurité et de la surveillance », estime le directeur de recherche américain. La stratégie diffère pour un virus HP car il induit un risque de santé publique (zoonose) et des enjeux économiques plus importants (mortalité des troupeaux de volaille). La lutte passe d’abord par l’élimination des troupeaux touchés. « La plupart des épidémies HP des quinze dernières années dans le monde ont été stoppées grâce au programme d’abattage. C’est la méthode d’éradication la plus efficace. Lorsque l’abattage ne peut pas être réalisé à grande échelle, la vaccination peut alors être introduite. C’est un moyen de contrôle de la maladie, mais elle ne peut pas l’éradiquer à elle seule », insiste-t-il.
Il n’existe pas de vaccin universel contre l’IA
À l’échelle mondiale, la vaccination anti-Influenza aviaire a jusqu’à présent surtout concerné le sous-type H5 (en Chine, souche asiatique éloignée de la souche H5N1 détectée récemment en France). « Dans 95 % des cas, il s’agissait de vaccins inactivés huileux. Ils engendrent une immunité humorale spécifique. Les 5 % restants proviennent de vaccins recombinants. »
L’enjeu d’un vaccin anti-influenza est de permettre une immunité du troupeau suffisante pour arrêter la transmission du virus. « Le vaccin « parfait » empêche 100 % de l’infection et de l’excrétion virale », a expliqué Jan Stegeman de l’Université d’Utrecht aux Pays-Bas. « En conditions expérimentales, en poulet comme en canard, la vaccination avec des vaccins inactivés diminue fortement la diffusion mais les résultats sur le terrain sont plus aléatoires. »
Une opposition moins catégorique à la vaccination
La vaccination a souvent une connotation péjorative auprès des instances internationales. Elle a parfois été assimilée à une mauvaise biosécurité. En outre, l’efficacité des vaccins inactivés n’a pas toujours été celle attendue. « Leur qualité s’est beaucoup améliorée, même s’il subsiste des écarts entre produits », souligne Jan Stegeman. L’innovation dans les vaccins issus de la biologie moléculaire et dans les méthodes de détection, l’expansion des virus et leur menace grandissante sur l’industrie avicole mondiale contribuent à faire bouger les lignes en faveur de la vaccination. L’USDA a décidé de stocker 150 millions de doses de vaccins H5 de nouvelle génération (vaccin recombinant, vaccin réplicon). Les Américains craignent une possible rechute de foyers hautement pathogènes suite à l’épidémie de H5N2 qui a durement touché les filières ponte et dinde en 2015. Il s’agirait dans ce cas de réaliser une vaccination en anneaux (vaccination compartimentée autour d’un foyer et non pas à grande échelle).
En France, l’option de la vaccination n’est pas d’actualité car la priorité dans le Sud-Ouest est aujourd’hui d’assainir les élevages par les mesures de biosécurité et d’élimination des lots touchés. Mais le risque de rechute ne peut malheureusement pas être écarté. L’intérêt des vaccins de nouvelle génération, conçus pour l’espèce Gallus, reste à démontrer sur les espèces "mineures" comme le canard mulard.
Il faudrait par ailleurs que les réglementations internationales tiennent compte de l’évolution des technologies de vaccination. Les pays qui vaccinent sont sous embargo et ne peuvent plus exporter.
Une protection plus large des vaccins recombinants
Beaucoup d’espoirs portent sur les vaccins de nouvelle génération issus de la biologie moléculaire, dont les vaccins recombinants. Ces derniers sont constitués d’un virus vivant atténué qui sert d’hôte (herpès virus HVT, variole…), dans lequel est inséré du matériel génétique codant pour les antigènes spécifiques du virus cible (H5 par exemple). « Administrés au couvoir, les vaccins vecteurs HVT induisent une meilleure protection et réduisent davantage l’excrétion du virus par rapport à des vaccins inactivés», a souligné Marcelo Paniago, de Ceva. « Lors d’essais sur le vaccin vectorisé de Ceva, la quantité de virus excrétée était divisée par un million par rapport à celle d’animaux non vaccinés et par trois cents par rapport à des animaux vaccinés à l’aide de vaccins inactivés. Il a montré son efficacité sur plusieurs sous-types H5 suite à de nombreux essais sur des poulets et des dindes."
Par ailleurs, ces vaccins, associés à de nouvelles méthodes de diagnostic (par PCR, par sérologie), facilitent la mise en œuvre de la stratégie Diva, dont l’objectif est de différencier les animaux infectés des animaux vaccinés. Indispensable pour prouver l’éradication du virus, le principe Diva est plus aisé avec des vaccins vecteurs (on recherche les anticorps contre la protéine H) qu’avec des vaccins inactivés (difficultés à différencier les anticorps liés au vaccin ou au virus sauvage).