Sanitaire : Endiguer les boiteries du poulet liées aux germes E. cecorum
Connu depuis quarante ans et pathogène depuis vingt, le germe intestinal Enterococcus cecorum est devenu une problématique sanitaire mondiale du poulet à croissance rapide. Comment agit-il et comment prévenir ses manifestations pathologiques.
Connu depuis quarante ans et pathogène depuis vingt, le germe intestinal Enterococcus cecorum est devenu une problématique sanitaire mondiale du poulet à croissance rapide. Comment agit-il et comment prévenir ses manifestations pathologiques.

« Une maladie du poulet à croissance rapide ayant des causes multifactorielles »
Les expressions cliniques d’une souche E. cecorum pathogène sont bien décrites chez le poulet, avec des symptômes qui évoluent selon l’âge.
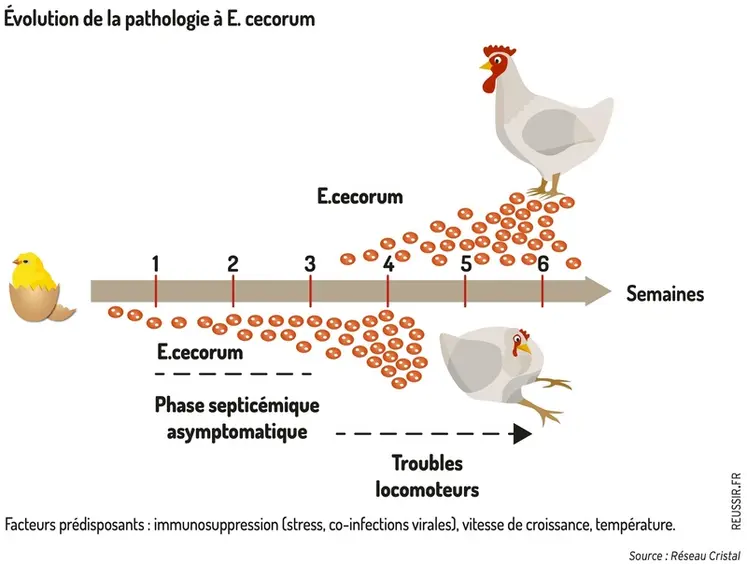
Chez le poussin, cela commence en première semaine par une baisse de consommation alimentaire et de la déshydratation – d’où un accroissement de l’hétérogénéité du lot – puis par des difficultés à marcher chez les malades de plus en plus nombreux.

Les boiteries s’amplifient vers les deux à trois semaines, avec des poulets ayant une patte écartée ou bien assis sur le croupion les deux pattes en avant (« poulet bascule ») . Elles conduisent au dépérissement, avec de la douleur ressentie par les poulets affectés, du tri important au cours du lot, et au final des saisies à l’abattoir et une baisse des performances technicoéconomiques.
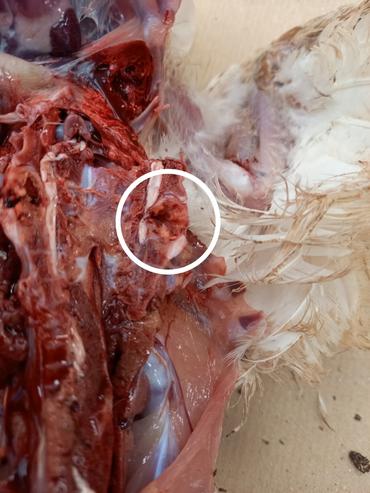
À l’autopsie, le squelette est atteint en des points précis de la colonne vertébrale ainsi qu’aux articulations des pattes (tête fémorale nécrosée), mais pas que. D’autres organes sont touchés : le cœur (péricardite), le foie (périhépatite, hypertrophie), la rate (hypertrophie), le cerveau.
Une maladie des poulets à croissance rapide
Cette pathologie locomotrice n’affecte pas tous les types de poulets, même si des cas sont parfois constatés en pondeuse. « On ne retrouve pas d’E. cecorum impliqué dans les troubles locomoteurs des poulets label et bio », a assuré Claudio Chimienti, vétérinaire en Côtes d’Armor et membre du réseau Cristal, lors d’une rencontre sanitaire organisée par Innozh à Ploufragan (22) au mois de juin 2024.

Le poulet rendu génétiquement boulimique est capable de déposer du muscle, mais sa capacité de digestion n’est pas à la hauteur de son appétit. Tout comme son aptitude à former à coup sûr un squelette assez robuste pour supporter sa masse.
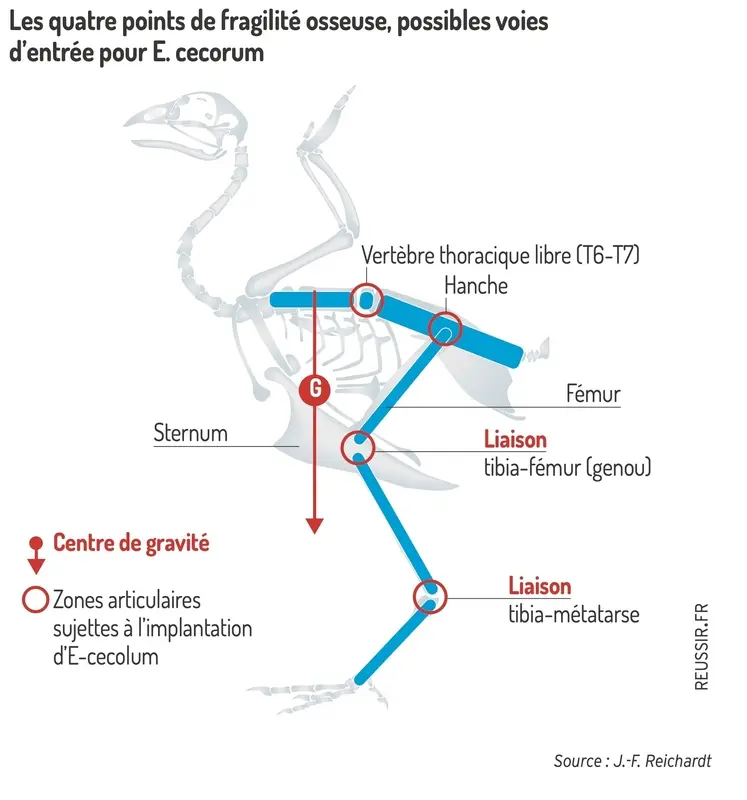
L’hypothèse la plus probable du déclenchement du processus est l’accumulation de matière alimentaire dans le tube digestif du poussin et la présence d’E. cecorum ingérés dans l’environnement immédiat. « E. cecorum représente seulement 3 % des germes retrouvés au démarrage dans notre réseau Cristal en 2022, mais c’est 47 % en pathologie locomotrice, loin devant E. coli O78 (21 %) et S. Aureus (12 %) », souligne le vétérinaire.
Enchaînement de circonstances favorables
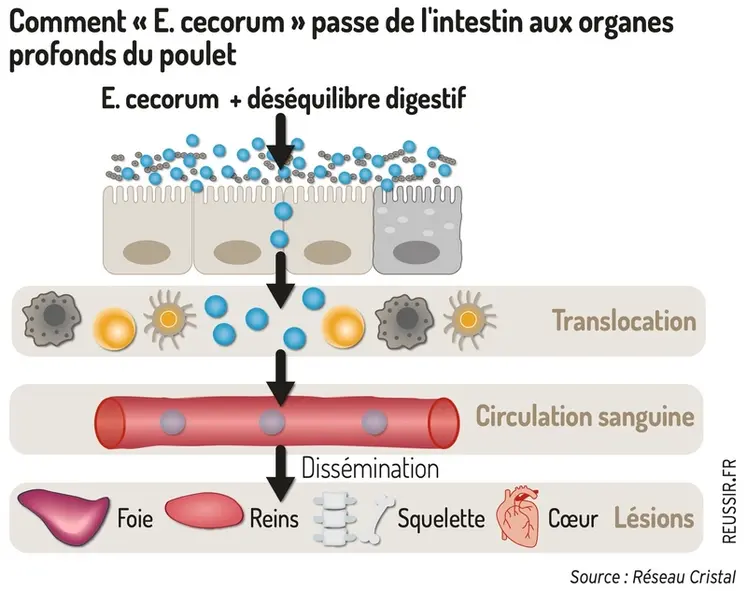
L’engorgement alimentaire permet à certaines souches d’E. cecorum de proliférer et de provoquer un désordre digestif avec une inflammation de la paroi intestinale.
Affaiblies, les cellules de l’intestin laissent le germe passer dans la voie sanguine. Ce phénomène de « translocation » a lieu au bout d’une à deux semaines de vie.
Le poussin étant très résistant à la présence de germes dans le sang, la bactérie va se disséminer dans les organes. Les os sont une cible privilégiée, en particulier les zones de multiplication cellulaires très fortement vascularisées et celles subissant de fortes contraintes mécaniques. La bactérie y fait son nid et provoque les lésions.
Connaissances à approfondir
Malgré l’ampleur mondiale de la pathologie, les chercheurs et les vétérinaires manquent d’informations sur E. cecorum. La pathologie ne s’exprime qu’avec certaines souches qui ont la capacité à coloniser fortement l’intestin et à traverser la paroi intestinale fragilisée.

« Pour l’instant, il est difficile de distinguer les souches de portage et celles qui sont pathogènes, résumait Florence Tardy, scientifique à l’Anses, lors du partage d’expérience organisé par Innozh. On retrouve bien des gènes de virulence, mais ils ne sont pas spécifiques des souches pathogènes. On n’arrive pas non plus à identifier des groupes pathogènes. Notre seule certitude est que ces souches sont génétiquement moins diversifiées et possèdent moins de gènes. »
Même avis de Claudio Chimienti : « On ne trouve pas de corrélations des souches pathogènes avec les élevages, les âges, les lésions, la diffusion. Et les techniques actuelles ne permettent pas de différencier une souche pathogène d’une commensale. »
Moyens de traitement limités
Qui dit bactérie pathogène, dit souvent vaccination préventive. « Jusqu’à présent, les essais de vaccination des reproducteurs ou des poulets commerciaux sont un échec total », résume Claudio Chimienti. Reste le traitement antibiotique, à condition de le faire au bon moment avec une matière active autorisée. Le traitement actuellement disponible n’est pas entièrement satisfaisant. Administré tardivement au regard de l’évolution de la maladie, l’antibiotique ne guérit pas les boiteux qui continuent à souffrir. Des rechutes peuvent se produire et E. cecorum peut réapparaître au lot suivant. Deux causes sont évoquées : persistance dans un réservoir proche (rongeurs ? insectes ? litière ? poussière ? matériel ?) ou élimination incomplète du germe sur le cheptel traité.
Réduire les risques de déclenchement
Faute de méthodes de diagnostic suffisamment précoces et de traitement antibiotique préventif légal, les éleveurs misent sur l’atténuation des facteurs de risque à trois niveaux.
Pour commencer, il s’agit de diminuer la présence de la bactérie sur le site d’élevage. Les mesures générales de biosécurité, le renforcement des procédures de nettoyage-désinfection, la surveillance de la qualité de l’eau sont autant de leviers à cumuler pour éviter la persistance d’E. cecorum et son passage sur les poussins.
Le second niveau d’intervention concerne tout ce qui peut permettre d’éviter le déséquilibre digestif et le passage de la bactérie dans le sang. Ce qui implique d’améliorer l’assimilation et la qualité de l’aliment (digestibilité, minéraux, vitamines, additifs nutritionnels), de protéger l’intestin en agissant notamment sur la flore digestive (probiotiques, anticoccidiens, acidification de l’eau), et d’apporter un confort maximal au poussin (minimiser les coups de froid et de chaud, régler le matériel).
Le troisième levier de prévention s’intéresse au squelette en limitant les fragilisations osseuses qui font le lit d’E. cecorum. La pratique précoce de 8 heures quotidiennes et continues d’extinction lumineuse facilite la régulation alimentaire et l’assimilation minérale.
Le poids à 10 jours est important à suivre, selon le vétérinaire Claudio Chimienti. Au-dessus du niveau souhaitable, le poussin est peut-être déjà en situation sanitaire défavorable. En dessous, l’éleveur peut être tenté de stimuler la consommation alimentaire, ce qui risque d’augmenter les risques.
À cela s’ajoutent des complémentations en minéraux (calcium et phosphore) à la hauteur des besoins et des boosts de vitamine D3 bio disponible qui vont stimuler l’utilisation des minéraux par l’organisme.
Inexorable montée en puissance
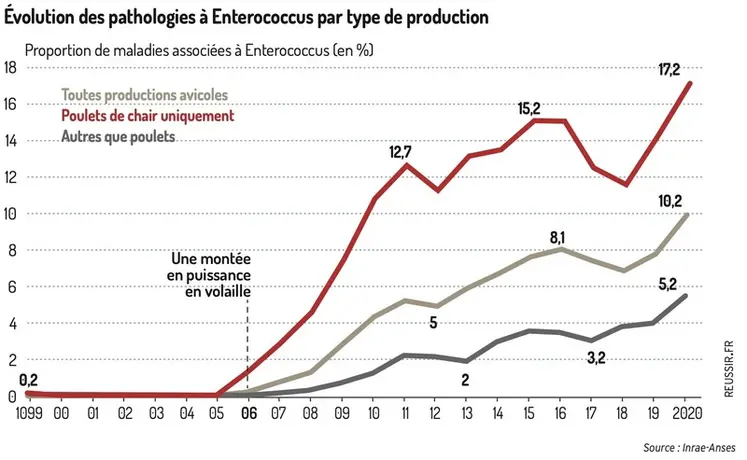
Comme E. Coli, les entérocoques sont des germes « commensaux » qui composent normalement le microbiote intestinal. Ce genre bactérien compte une cinquantaine d’espèces, dont Enterococcus cecorum.
L’espèce fut découverte en 1983 sur du poulet en Belgique, puis sur d’autres oiseaux domestiques et sauvage, ainsi que le porc, le cheval, la vache. Même sur des patients hospitalisés exprimant des symptômes variés (septicémies, endocardites, péritonites, infections urinaires)
E. cecorum a vraiment commencé sa carrière pathogène en Europe en 2002. En France, les entérocoques (E. cecorum, E. faecalis, E. hirae) sont apparus dans les statistiques des laboratoires d’analyses vétérinaires à partir de 2005, avec 0,4 % des cas totaux comptabilisés par le Réseau national d’observations épidémiologiques en aviculture (RNOEA). Ce pourcentage n’a cessé de croitre depuis, dépassant 17 % des cas pathologiques en 2020 chez le poulet.











