[VIDEO] Utiliser des tamis pour identifier et quantifier les vers parasites des volailles
Une nouvelle méthode d’identification et de quantification des vers parasites des volailles a été mise au point par l’Anses avec l’appui de l’Itavi. Des formations sont proposées pour la mettre en œuvre.
Une nouvelle méthode d’identification et de quantification des vers parasites des volailles a été mise au point par l’Anses avec l’appui de l’Itavi. Des formations sont proposées pour la mettre en œuvre.

Les méthodes actuelles de dépistage des vers parasites – les helminthes – ne sont pas satisfaisantes. L’examen des fientes (coproscopie) et l’observation directe des vers présents dans le tube digestif d’animaux autopsiés ne permettent pas l’identification de tous les types d’helminthes et une évaluation fiable du niveau d’infestation. La nouvelle méthode proposée par Jean-Michel Repérant, de l’Anses-Ploufragan, est fiable, rapide (moins d’une heure) et peu coûteuse. Elle est effectuée en réalisant une filtration du contenu intestinal ou cæcal avec des tamisages successifs de plus en plus fins. Des formations sont proposées par l’Itavi aux vétérinaires et personnels de laboratoire d’analyses vétérinaires, avec un volet théorique et une partie pratique. Un tutoriel et une vidéo sont disponibles sur le site internet de l’Itavi. Voici en quoi elle consiste.
1/ Préparation du contenu digestif à examiner
2/ Premier tamisage à maille de 1 millimètre
Ce tamis est bien lavé avec un jet d’eau sous pression, le filtrat étant toujours dans ce second cristallisoir. Le tamis est ensuite retourné et lavé au-dessus du premier récipient rincé, de façon à décoller tout ce qui a été retenu.
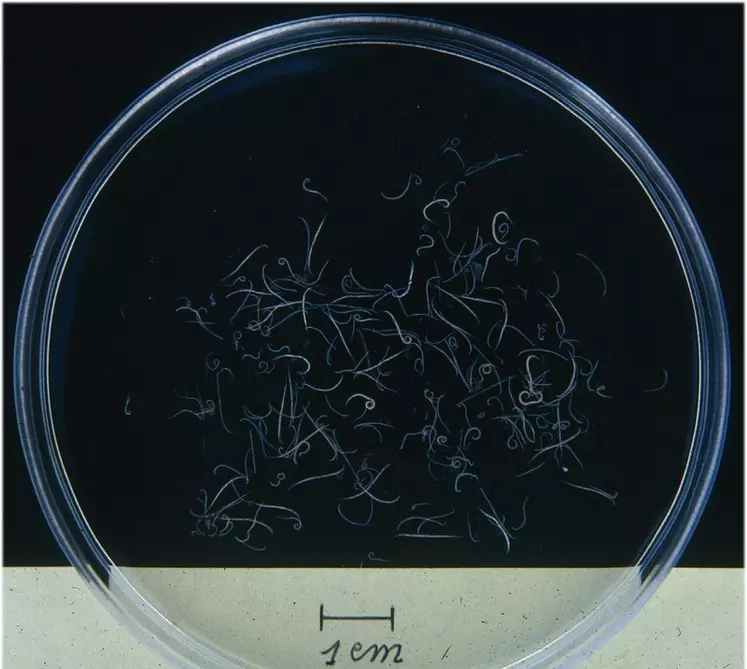
Des têtes de cestodes et de petits Ascaridia peuvent ainsi être récupérés. La suspension récupérée pour être examinée et dénombrée sur fond noir, ou prélevée pour une identification sous microscope.
3/Deuxième tamisage à 250 micromètres
Le filtrat du second cristallisoir est passé sur un tamis de maille de 250 µm en suivant la même procédure de rinçage. La suspension est observée sur fond noir pour rechercher des formes juvéniles d’Ascaridia et des capillaires. Les capillaires étant très petits et très fins, il faut examiner la suspension minutieusement et de très près.
4/Troisième tamisage à 100 micromètres
Le filtrat est passé sur un troisième tamis de 100 µm de porosité. La fraction traversant le tamis n’est pas récupérée, et le tamis est bien lavé. Son contenu est récupéré et observé sur fond noir pour la recherche de capillaires principalement, même si des formes juvéniles d’Ascaridia peuvent être présentes. Pour les recherches dans les caeca, le tamisage se fait seulement avec les tamis de 1 mm et 250 µm avec une observation sur fond noir de la même façon.
Mise en place d’un observatoire
Cette avancée méthodologique a permis de mettre en place un observatoire des infestations par des vers, ouvert à tous les laboratoires vétérinaires et aux organisations de production. Il permettra de dresser un état des lieux de l’infestation parasitaire par les helminthes dans des élevages de volaille chair (label ou bio) et pondeuses (plein air ou bio). Pour en savoir plus, contactez : A.-C. Lefort (lefort@itavi.asso.fr) ou J.-M. Repérant (jean-michel.reperant@anses.fr).
Pourquoi détecter et identifier les vers
Il est essentiel de détecter et d’identifier précisément afin de juger de l’opportunité d’un traitement parce que :
Les limites de la coproscopie et de l'examen direct
La recherche des œufs dans les fientes, dite aussi coproscopie, est la méthode la plus utilisée pour suivre les infestations helminthiques, mais elle est imparfaite.